2026年1月5日,仟源医药宣布旗下两家核心子公司分别获得了依伏卡塞的片剂注册证书及原料药上市批准,依伏卡塞片更是成为该品种的国内首仿。
本次药品的获批将丰富公司产品结构,提升公司在市场的竞争力,对公司未来经营业绩的提升产生积极影响。
01、首仿药与原料双获批
仟源医药公告披露,公司产品“依伏卡塞片(1mg、2mg)”于近日收到国家药品监督管理局签发的《药品注册证书》,该产品由公司子公司杭州仟源保灵药业有限公司(以下简称“仟源保灵”)生产,适用于治疗维持性透析患者的继发性甲状旁腺功能亢进症。
据了解,仟源医药依伏卡塞片已于2024年9月取得药品注册受理通知书,历时一年多终于拿到批文。
值得注意的是,依伏卡塞片原研药品由日本协和麒麟(Kyowa Kirin)和田边三菱制药公司共同研制。公司依伏卡塞片是国内首仿获得《药品注册证书》,并视同通过一致性评价,该品种已被列入国家医保目录乙类,系2025年国家医保目录新增品种。
此前,该药国内市场由日本协和麒麟的原研药独家供应,价格较高。根据药渡数据显示,依伏卡塞片原研药零售终端价格约为700元/盒。仟源医药的首仿上市后,有望降低患者用药负担,并快速切入这一市场。
同时,仟源医药还公布,另一子公司——江苏嘉逸医药有限公司(以下简称“嘉逸医药”)旗下的依伏卡塞获得《化学原料药上市申请批准通知书》。此次原料药与片剂同时获批,或将为未来应对可能的市场竞争提供成本保护。
其实,这并非仟源医药第一次斩获首仿药剂。2024年底,其另一款重磅首仿药精氨酸培哚普利片获批上市并实现量产销售,其原料药也一同获批。值得关注的是,这两款首仿药片与原料药背后的公司与此次一样分别是仟源保灵和嘉逸医药。
02、持续研发投入赋能高端制药战略
仟源医药成立于2005年,注册资本2.56亿元,2011年8月19日在深交所创业板成功上市,成为山西第二家创业板公司。该公司是一家集研发、生产、营销为一体的医药上市企业,在其发展过程中,仟源医药不断通过外延式并购和投资迅速抓取市场机遇,优化产品结构,实现了跨越式发展。
2020年公司确定了“以高端制药为核心,精准医疗和保健食品为侧翼”的发展战略。
截至目前,集团旗下拥有仟源保灵、浙江海力生制药、嘉逸医药、杭州恩氏基因、四川仟源中药、无锡联合利康检验以及西藏仟源等10家全资和控股子公司。
其中,本次新药的持有企业仟源保灵成立于1994年,于2013年9月成为仟源医药的子公司。该企业核心产品包括“保灵孕宝”口服液、依巴斯汀片等,近年来生产了包括依伏卡塞片的两支首仿药,还于2024年12月收到国家药品监督管理局签发的“麦芽酚铁胶囊”《药物临床试验批准通知书》,是公司在市场上具有竞争力的子公司之一。
依伏卡塞片的原料药上市获批企业嘉逸医药成立于2013年10月9日,是由香港Joy Glory Limited投资的高新技术企业,专注于高端仿制药及创新药研发生产。2025年完成股权转让后,成为仟源医药的子公司。
除2025年获批的首仿药外,早在2020年,仟源医药子公司杭州澳医保灵药业就收到了国家药品监督管理局核准签发的依巴斯汀片的《药品补充申请批件》,该药品通过仿制药质量与疗效一致性评价,亦为当时国内首家过评。
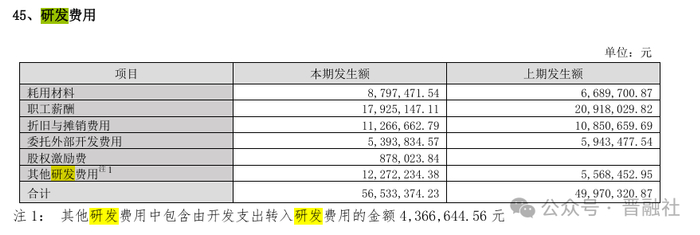
近年来,仟源医药在研发上的投入也持续增长。根据公司2024年年报显示,仟源医药2024年实现营业收入8.47亿元,同比增长5.92%;其研发费用达到5653万元,同比持续增长13.13%;仟源医药在建工程中还包括,依伏卡塞可移动研发平台。
仟源医药表示,依伏卡塞片及其原料药的获批,将会拓展公司产品线,提升整体竞争力。未来,切实把握好首仿药品的市场窗口期,加速其全国招商布局,有望为公司新的核心利润增长点。
>>>查看更多:股市要闻